1团队负责人介绍

黄玲 教授,博士生导师,药学院副院长(挂职)。中山大学药物化学博士,2015年荣获广东省“特支计划”科技创新青年拔尖人才和广州市珠江科技新星专项人才称号,2016年赴美国Scripps研究所神经生物学系访学,2021年通过高层次人才引进到海南大学工作。
针对“高效设计和发现神经退行性疾病”重大科学难题,结合药物化学、化学生物学、神经药理学等理论及实验技术,致力于神经退行性疾病创新药物设计与发现研究,在J. Med. Chem., Eur. J. Med. Chem.等国际期刊发表 SCI 论文 61 篇,其中第一作者或通讯作者论文39篇(中科院大类一区Top期刊论文11篇/JCR分区Q1 论文19篇),他引 2000余次,3篇论文他引超过100次,单篇最高他引 151次,h-index 30。申请中国发明专利15项,已获授权专利4项,其中三项专利成果已与企业签订新药合作开发协议。
个人简介:https://hd.hainanu.edu.cn/yaoxue/info/1029/2398.htm
2团队介绍
面向国家重大需求,团队以海南省热带特色药用作物与海洋资源为依托,聚焦“神经退行性疾病与慢性肝病创新药物”两个重大科学难题,结合天然药物化学、合成药物化学、化学生物学、计算机辅助药物设计、药理学、细胞分子生物学等理论及实验技术,在“高活性药物分子指导新靶点发现”与“新靶点指导创新药物设计优化”双重模式驱动下,致力于神经退行性疾病、慢性脂肪肝病等重大疾病的药化药理一体化研究,从而实现新药创制。当前,团队已配备天然药物化学、合成药物化学、药理学与细胞分子生物学等方向领域师资力量。
3团队成员
饶勇 研究员,海南省高层次人才,聚焦“慢性代谢类疾病与神经退行性疾病”新靶点发现与创新药物研究,发展了多个NASH药物研究新靶点与多个临床前药物分子,已在药物化学、药理学等国际重要学术刊物如Acta Pharmaceutica Sinica B, Pharmacologic Res, Gut Microbe、Br J Pharmacol、J Med Chem等期刊发表SCI论文20多篇,授权中国发明专利6项,PCT专利3项。主持/参与多项国家/省部级项目,包括国家自然科学基金重点项目、面上项目、国家青年基金、海南省自然科学基金等。
个人简介:https://hd.hainanu.edu.cn/yaoxue/info/1029/2901.htm
徐从军 副教授,海南省高层次人才,致力于创新小分子药物的研究,在抗药物设计、合成以及生物评价方面积累了丰富的经验。近年来聚焦医学前沿领域,结合化学生物学和分子生物学等学科技术在抗肿瘤药物研究领域开展了一系列基础与应用研究。已发表SCI论文10余篇,主持科研项目3项。
个人简介:https://hd.hainanu.edu.cn/yaoxue/info/1029/3038.htm
江仲平 副研究员,海南省高层次人才,聚焦南海特有的药用海洋生物资源(微生物、动物、植物)和海南特色南药(黎药)挖掘抗感染、抗病毒、抗AD以及治疗代谢类疾病的药物先导化合物。在红树植物萜类和海洋甲藻超级碳链化合物的快速发现、结构鉴定和药理活性评价方面积累了丰富的经验。近五年科研成果突出,以第一作者或共同第一作者在Chem Sci、Org Chem Front、Bioorg Chem等杂志发表SCI论文6篇,参与国自然基金重点项目和国际合作项目2项。
个人简介:https://hd.hainanu.edu.cn/yaoxue/info/1029/3071.htm
刘进 副研究员,海南省高层次人才,在药物设计、合成以及生物评价方面积累了丰富的经验。近年来围绕抗代谢性疾病药物、肿瘤免疫小分子药物和靶向蛋白降解的抗炎药物等研究领域开展了一系列基础与应用研究。在J Med Chem, Eur J Med Chem等期刊发表SCI论文6篇,申请专利6项,参与科研项目3项。
个人简介:https://hd.hainanu.edu.cn/yaoxue/info/1029/3271.htm
4团队研究方向
(1)海洋与南药(黎药)来源的先导化合物发现;
(2)小分子化合物设计、合成与优化;
(3)抗神经退行性疾病与慢性脂肪肝病新靶点与新机制研究;
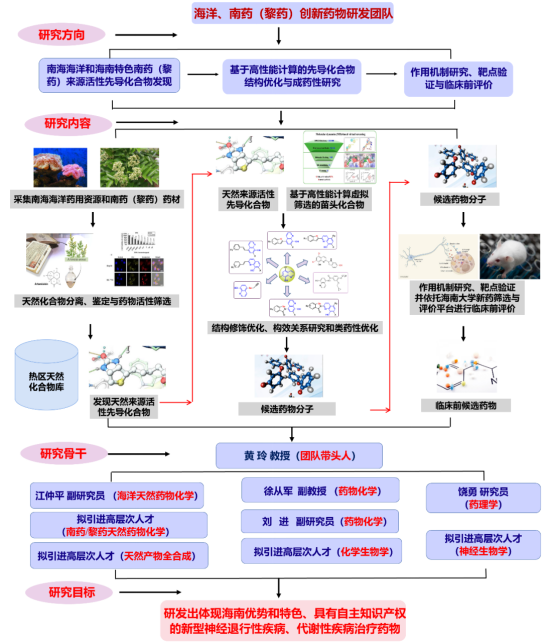
4团队代表性成果
科研项目
(1) 国家自然科学基金地区项目: 选择性磷酸二酯酶II抑制剂设计、成药性及抗阿尔兹海默病作用研究,2022 - 2025,主持人:黄玲
(2)海南大学 C 类高层次人才引进经费,2021-2025,主持人:黄玲
(3)国家自然科学基金面上项目, 新型多靶点抗阿尔茨海默病喹啉衍生物:设计合成、生物活性与分子机制研究,2018 - 2021,主持人:黄玲
(5) 国家自然科学基金地区项目: NASH治疗新靶点ASNS蛋白抑制剂设计合成及其增强肝脏线粒体代谢活性研究,2023 - 2026,主持人:饶勇
(6) 国家自然科学基金青年基金: 新型苯并噻吩类GPX4抑制剂的类药性优化及其诱导铁死亡抗肿瘤多药耐药研究,2023 - 2026,主持人:徐从军
(7) 国家自然科学基金青年基金: 红树植物海漆来源的甘遂烷型FXR激动剂发现、结构优化及其抗NASH活性研究,2023 - 2026,主持人:江仲平
近五年代表性论文及介绍
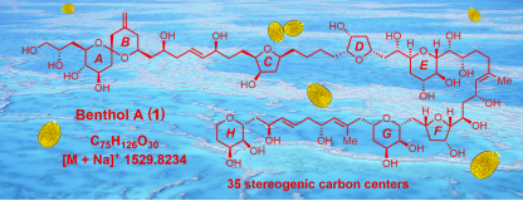
(1)南海前沟藻属底栖甲藻新物种中超级碳链化合物新家族成员Benthol A发现
超级碳链化合物(Super-Carbon-Chain Compounds)的骨架为一根高度氧化的从头彻尾碳碳链接而成的长碳链,为海洋天然产物特有类型。其分子量巨大、手性中心繁多,NMR氢、碳信号重叠,绝对立体化学确立极具挑战性。迄今,该类化合物最具代表性的两大家族为多羟基-多烯化合物和梯形聚醚化合物。本世纪以来,极少有超级碳链化合物的新家族报道。该论文从中国南海前沟藻属底栖甲藻新物种中发现了超级碳链化合物的新家族成员Benthol A,并综合运用了波谱解析、化学降解和量子化学计算三种方法,尤其是2D-INADEQUATE碳-碳耦合NMR波谱技术,成功地诠释其结构和绝对立体化学。该项研究成果以“Edge Article”在国际著名化学期刊Chemical Science (IF9.825)上发表题为“Discovery of benthol A and its challenging stereochemical assignment: Opening up a new window for skeletal diversity of super-carbon-chain compounds”的研究论文。江仲平老师为论文第一作者。
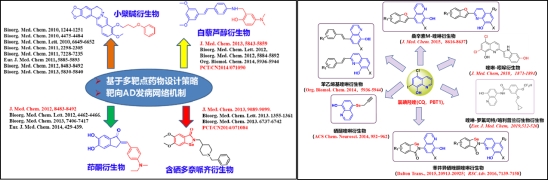
(2)神经退行性疾病先导化合物发现及其优化
通过高通量药物筛选获得的活性天然产物小檗碱和白藜芦醇为先导化合物,设计和构建了小檗碱衍生物和白藜芦醇衍生物化合物库,筛选出2个具有多靶点抗AD的候选药物分子。该研究成果受到了国际国内同行的高度关注和认可,单篇最高引用数151次,申请人受邀撰写天然产物在AD药物研究方面的综述,其中发表在J. Med. Chem的论文受到“AD生物金属离子稳态失衡假说”提出人Ashley I. Bush教授评价称“化合物设计思路新颖、活性优异”,并应邀与其合作进行候选化合物R-22d新药开发研究。同时,团队设计和优化了新骨架喹啉衍生物,发现了具有PDE4抑制活性、可显著改善转基因小鼠认知记忆功能的多靶点抗AD药物WBQ5178,已与深圳海王药业有限公司签定协议合作进行后期开发(中科院大类一区top期刊论文JMC2015,授权专利ZL201510581395.3);发现了具有促进大脑海马成体神经形成、有望成为全新机制的神经退行性疾病治疗药物的先导化合物WI-1758(中科院大类一区top期刊论文JMC2018,授权专利ZL201711071039.2)。
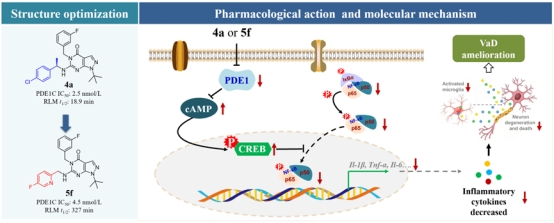
(3)靶向抑制PDE1阻断神经炎症治疗小鼠血管性痴呆
神经炎症是中枢神经系统中由小胶质细胞和星形胶质细胞激活的免疫应答。研究已证实,神经炎症诱发与VaD发生密切相关。靶向神经炎症相关蛋白或通路被认为是治疗VaD有效策略。磷酸二酯酶1(PDE1)是磷酸二酯酶家族的成员之一,可同时水解第二信使cAMP和cGMP,高表达于脑组织。PDE蛋白介导的相关信号通路参与了炎症与神经损伤。然而,围绕PDE1能否作为神经炎症与VaD药物设计靶点没有确切定论。饶勇研究员与罗海彬教授及中山大学药学院吴一诺副教授合作在前期报道的化合物3m基础上,通过结构改造发展了高抑制活性与高亚型选择性的PDE1抑制剂4a与5f。化合物抑制PDE1激活PKA/CREB通路,阻断炎症关键蛋白NF-κB磷酸化及其转录调节活性,抑制神经炎症,治疗VaD。同时,作者基于获得的构效关系进一步优化了化合物类药性,发展了第二代PDE1抑制剂5f。该研究将自主开发的高选择性PDE1抑制剂应用于VaD,提出了靶向抑制PDE1干预神经炎症治疗VaD的新策略及其可应用性,证实PDE1是VaD新药创制的潜在新靶标。该研究以PDE1蛋白为切入点,发展了新结构高活性、高选择性PDE1抑制剂,将靶向抑制PDE1与VaD联系在一起,揭示了靶向抑制PDE1阻断神经炎症治疗VaD分子机制。为神经炎症与VaD的创新药物研发提供原始创新的药物靶标以及结构基础。该项研究在Acta Pharmaceutica Sinica B(IF14.911)上发表题为Discovery of novel phosphodiesterase-1 inhibitors for curing vascular dementia: Suppression of neuroinflammation by blocking NF-κB transcription regulation and activating cAMP/CREB axis的研究论文。
(4)靶向激活肝脏线粒体氧化有效治疗小鼠慢性脂肪肝病
肝脏脂肪异位蓄积介导的肝脏损伤(肝细胞凋亡)、炎症与纤维化是非酒精性脂肪肝(NAFLD)与非酒精性脂肪肝炎(NASH)主要特征。其中,脂质蓄积介导的线粒体氧化应激与损伤是慢性脂肪性肝病关键机制。研究证实,增强肝脏线粒体氧化是NAFLD与NASH潜在有效干预策略,但肝脏线粒体代谢调控靶点与分子机制依然未知。以发展的高活性药物分子为分子工具,研究发现激活小鼠机体代谢或靶向增强肝脏线粒体代谢均可有效逆转小鼠NAFLD与NASH(Br J Pharmacol, 2017/2019/2022a; Pharmacol Res., 2022; Gut Microbes, 2021)。基于上述研究,我们首次提出:靶向激活肝脏HSF1或增加肝脏L-天冬氨酸水平是干预NASH的潜在新干预策略。近期,我们进一步研究发现增强肝脏HSP72与过氧化还原酶(PRDX6)相互作用可增强线粒体自噬,促进损伤线粒体降解与生物合成,从而治疗NAFLD(Br J Pharmacol., 2022b),首次揭示了HSP72调控肝脏线粒体代谢新功能。

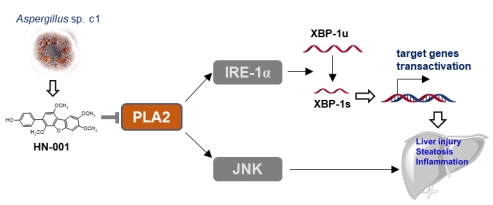
近期,团队利用肝细胞脂质蓄积细胞模型从海洋微生物Aspergillus sp. c1代谢物中筛选发现化合物HN-001可有效降低肝细胞脂质水平,并抑制脂质毒性。进一步机制研究发现HN-001通过抑制磷脂酶A2(PLA2)活性,抑制应激与损伤关键通路IRE-1α/XBP-1s与JNK,保护肝细胞,从而治疗小鼠NAFLD。
授权发明专利
(1)黄玲、饶勇、郭志凯、徐从军、苏睿,2022,一种海洋曲霉菌来源化合物的应用,申请号2022106487114,中国发明专利
(2)黄玲、潘廷婷、周彦、黎兴术,2020,喹啉色胺杂联体在其制备治疗阿尔兹海默病的药物中的应用,ZL202010522268.7,中国发明专利
 联系地址:海南大学药学院
联系地址:海南大学药学院 联系电话/传真:0898-66254967
联系电话/传真:0898-66254967 E-mail:yxyyb@hainanu.edu.cn
E-mail:yxyyb@hainanu.edu.cn
