肿瘤相关抗原免疫原性弱、易引发免疫耐受,严重制约了相关疫苗的临床疗效。近日,海南大学药学院宗成利教授团队在《Angewandte Chemie International Edition》(影响因子16.1)和《International Journal of Biological Macromolecules》(影响因子7.7)发表两项研究,通过化学酶法全合成的肿瘤相关抗原与CRM197载体蛋白偶联技术与新型佐剂系统,协同驱动,成功将肿瘤抗原从“免疫逃逸”状态转化为“高效激活”模式,为癌症疫苗研发提供新思路。
肿瘤细胞表面过表达异常糖基化的MUC1、Globo H等抗原,本应成为免疫系统识别的“靶标”,却因异常糖基化修饰形成“免疫屏障”,导致传统疫苗难以激活有效应答。疫苗设计既要突破免疫耐受,又要避免误伤正常组织,如同在迷雾中精准狙击。
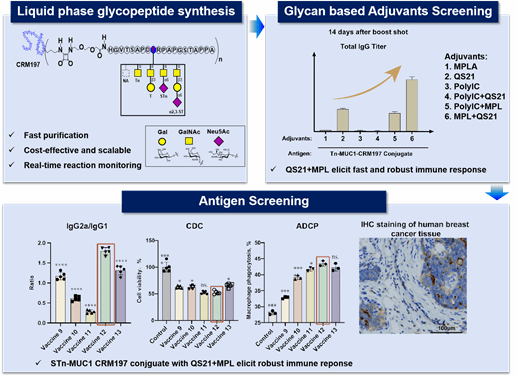
团队采用液相化学酶法合成技术,制备了四种MUC1糖肽抗原及Globo H六糖抗原,并将其与载体蛋白CRM197高效偶联。CRM197作为载体蛋白,可通过激活T细胞依赖的免疫激活,使宿主产生更强的免疫应答。
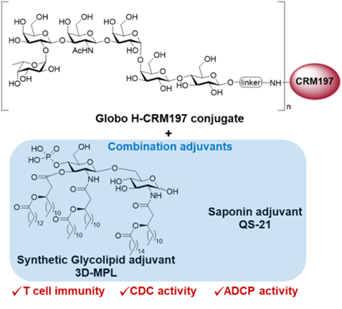
针对佐剂组合这一关键变量,团队开发了模块化合成策略,成功制备新型佐剂3D-MPL,并通过系统性筛选发现: MUC1抗原+(MPL+QS21)组合,Globo H抗原+(3D-MPL+QS21)组合可强效诱导Th1偏向性免疫应答,激活补体杀伤(CDC)与巨噬细胞吞噬(ADCP)效应。
新疫苗策略制备的抗体对MCF-7乳腺癌细胞系及临床肿瘤组织标本均表现出强结合力,且对MCF-7表现出强杀伤效应。双引擎策略既解决了抗原‘隐身’问题,又重塑了免疫微环境,让疫苗从‘无效应答’转向‘精准歼灭’。尤为关键的是,疫苗诱导的抗体高度特异性识别肿瘤相关糖抗原,避免对正常组织的脱靶损伤,为实体瘤治疗提供了更安全的新选择。
论文网址:https://www.sciencedirect.com/science/article/pii/S0141813025010748?via%3Dihub
论文网址:https://onlinelibrary.wiley.com/doi/10.1002/anie.202418948
发表在《International Journal of Biological Macromolecules》上的研究成果以海南大学为第一单位,生命健康学院2021级博士生滕长财为该论文的共同第一作者(排第一),药学院宗成利教授(最后通讯)、中科院上海药物所李铁海教授和河南大学李霞教授为共同通讯作者。发表在《Angewandte Chemie International Edition》上的研究成果,海南大学生命健康学院2021级博士生滕长财为该论文的共同第一作者(排第三),药学院宗成利教授、上海安奕康生物科技有限公司高祺博士、中科院上海药物所李铁海教授为共同通讯作者。
以上研究得到了国家自然科学基金、海南省自然科学基金等多项基金的支持。
 联系地址:海南大学药学院
联系地址:海南大学药学院 联系电话/传真:0898-66254967
联系电话/传真:0898-66254967 E-mail:yxyyb@hainanu.edu.cn
E-mail:yxyyb@hainanu.edu.cn
